
第一作者:赵昕悦通讯作者:吴海明通讯单位:东北农业大学资源与环境学院、山东大学环境科学与工程学院
图片摘要
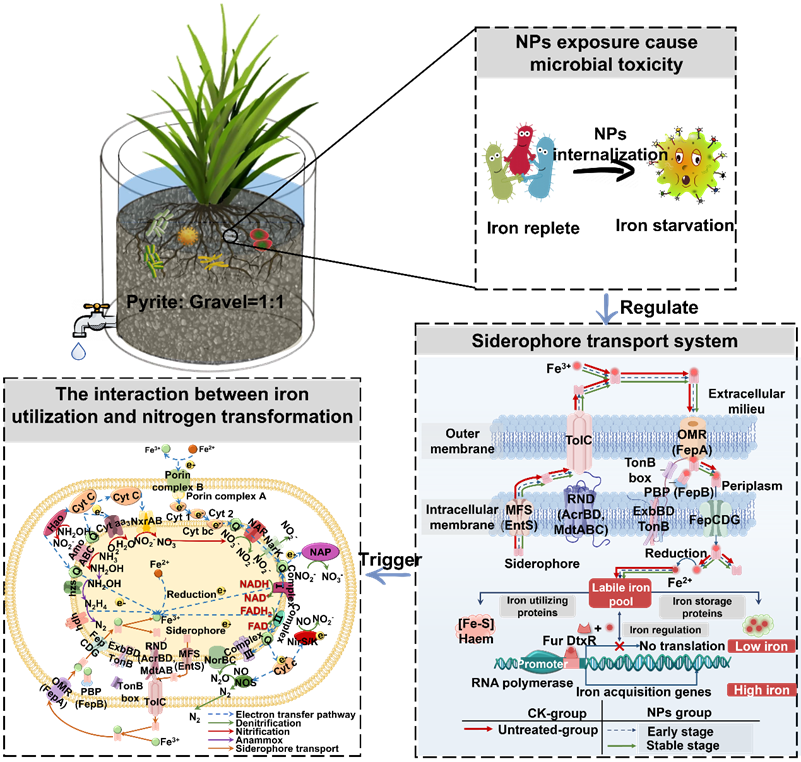
成果简介近日,东北农业大学资源与环境学院赵昕悦课题组和山东大学吴海明教授在环境领域顶级期刊Water Research(IF=12.8,中科院一区)发表了题为“Toxic Effects of Nanoplastics on Biological Nitrogen Removal in Constructed Wetlands: Evidence from Iron Utilization and Metabolism”的研究性论文。本研究主要揭示了纳米塑料内化会扰乱胞内铁稳态,进而限制微生物氮代谢中的电子传递过程。
引言
人工湿地(Constructed wetlands, CWs)作为一种环保且低成本的污水处理技术在全世界范围内被广泛应用。人工湿地中的微生物因其高效的酶产生和代谢能力,在污染物去除中起着至关重要的作用。基质作为微生物的附着位点,可提供微生物代谢所需的必需营养物质和电子。以黄铁矿(FeS2)为基质的人工湿地被广泛应用,其产生的含铁代谢物(如Fe2+、Fe3+等)可用于微生物的生长、繁殖。由微生物合成和分泌的铁载体是其在环境中捕获铁(Fe3+)并将其输送到细胞中的重要策略,进入细胞的Fe3+被还原为Fe2+,进而被铁硫簇和血红素的生物合成所消耗。进入细胞的铁离子还可以作为微生物介导的氮代谢的关键驱动因素,Fe2+可以作为反硝化微生物的有效电子受体,而Fe3+可用作末端电子受体氧化NH4+-N并促进厌氧氨氧化过程(Feammox)。铁离子的氧化还原与氮代谢相耦合,最终实现人工湿地的氮素去除。近年来,纳米塑料(NPs)造成的全球环境健康问题引起全球关注。以往的研究表明,NPs可通过地表径流和生活污水排放等方式积聚在废水处理系统中,其在废水中的含量可达61到1189μg/L。NPs在人工湿地系统中的聚集会引起植物和微生物毒性,进而影响人工湿地生物脱氮效能。NPs会攻击微生物电子传递系统,进而降低微生物硝化和反硝化效率。然而,NPs作为微生物介导的氮素去除的决定因素在很大程度上仍未被探索。此外,微生物铁的获取、利用和Fe-N耦合机制对NPs扰动的响应机制尚未明确。结合宏基因组测序,探索NPs对微生物抗氧化系统、铁浓度、铁载体运输系统和酶学的影响,并了解NPs暴露后的微生物群落和网络变化,最终明晰微生物铁利用与氮代谢的耦合机制。
图文导读
微生物通过内吞作用内化 NP,可能导致细胞毒性作用,抑制细胞生长、增殖和代谢。细胞毒性会引起ROS和MDA积累,结果显示与未处理组相比,NPs组的ROS和MDA含量显着增加(分别为4.68和2.42倍)。为维持胞内ROS 稳态,微生物激活了酶促抗氧化防御系统,例如CAT、POD和SOD。如图1B所示,与为处理组相比,NPs组的CAT、POD和SOD活性显著升高(分别为1.88、10.34 U/g FW)。ROS 和MDA 的积累表明细胞膜完整性受损,这可能导致离子泄漏。如图1C所示,未处理组的总铁离子浓度为NPs组的1.25倍,表明暴露于NPs会触发铁饥饿反应。作为一种补偿策略,铁载体转运系统被激活,通过细胞外铁螯合形成铁-铁载体复合物,进而被转运到细胞中。结果显示NPs内化显着增加了铁载体的生物合成,与未处理组相比,NPs组铁载体含量增加了9.72倍。这些结果表明,NPs暴露于不平衡的细胞铁离子稳态中,促使微生物通过调节铁载体的生物合成和转运进行体内铁离子浓度调节。
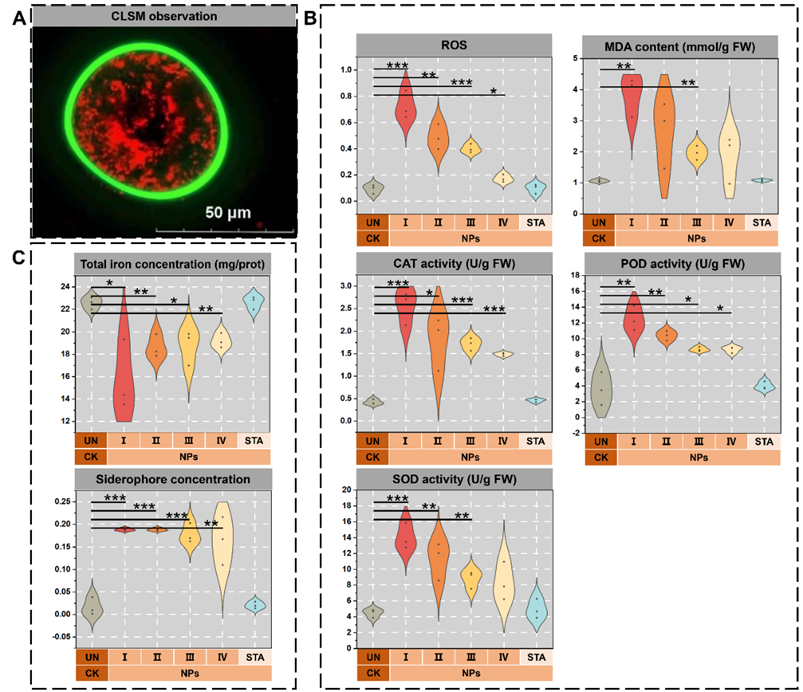
图1 (A)细胞内区域NPs的荧光图像;抗氧化酶活性、ROS水平、MDA含量(B)、总铁离子和铁载体浓度(C)对NPs积累的响应。UN和CK表示不添加 NPs的样品;STA表示CWs在添加NPs后180天后运行稳定状态的样品。
微生物已经发展出复杂的机制来调节铁离子的摄取和储存,以维持细胞内铁稳态。铁载体的生物合成和分泌在这一过程中扮演着重要角色,我们评估了铁载体运输系统对NPs暴露的响应机制。研究发现,与未处理组相比,NPs 组的编码铁载体分泌蛋白的基因表达显着增加 6.86%,表明细胞内铁离子在低浓度下会激活铁载体的合成,随后通过能量消耗的方式积极地进行分泌和吸收。随后细胞通过特定的受体系统高效地吸收这些铁载体,确保铁的供应以促进细胞生长和代谢。在足够的细胞内铁库存条件下,铁感应调节蛋白(Fur)通过调控转录来维持铁稳态,从而实现对铁的精准调节。研究结果显示,暴露于NPs初期,Fur的相对丰度减少,诱导铁载体的合成。到达稳定阶段,与未处理组相比,NPs 组编码Fur基因的相对丰度增加了2.66%,抑制了过量铁积累的副作用,有效地维护了细胞内的铁平衡。综上,微生物在铁环境波动中展现出生存需求与长期能量优化之间的微妙平衡,通过调节铁载体的合成、分泌和吸收,以有效应对外界环境的挑战。
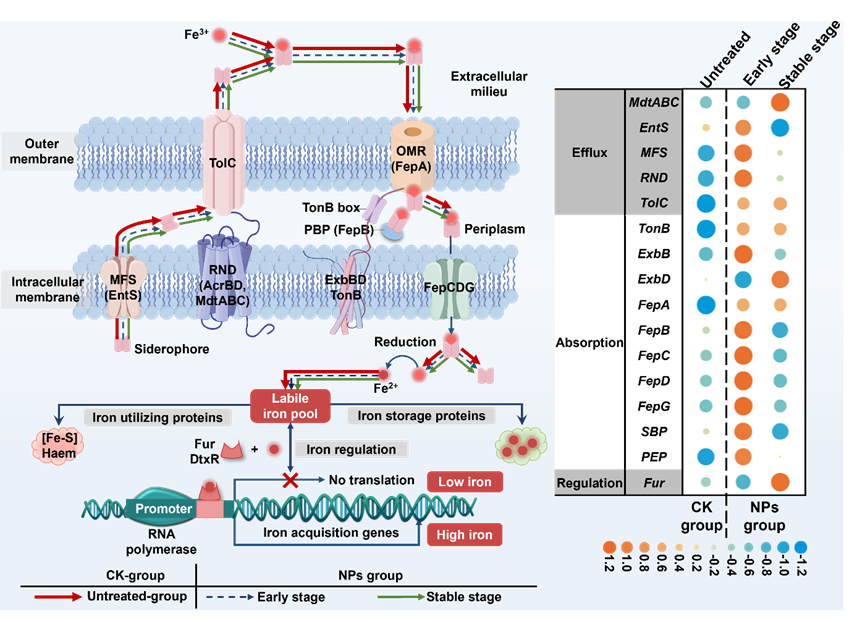
图2 微生物铁载体转运和调节响应NPs暴露的机制
电子传递链(ETC)在细胞代谢中起着至关重要的作用,特别是其中的复合物V(ATP合酶)促进了ATP的合成。研究发现,NADH作为电子供体对于维持能量生产至关重要。结果显示未处理组的NADH水平比NPs组高2.55倍,表明NPs组内化引起的铁剥夺限制了电子传递,进而减少了细胞中的ATP产生。这种能量代谢失调影响了细胞活力,导致NPs组的细胞代谢受到抑制。此外,氮代谢不仅依赖于充足的ATP供应,还依赖于关键酶的催化活性。研究还发现,NPs组中NAR和NIR的活性下降,这可能是由于铁剥夺导致稀缺的铁离子优先分配给其他含铁蛋白,使氮去除受到影响。综合来看,铁剥夺引发的ETC功能障碍不仅影响了细胞的能量代谢,也降低了氮代谢关键酶的活性,进而对微生物代谢和存活产生负面影响。
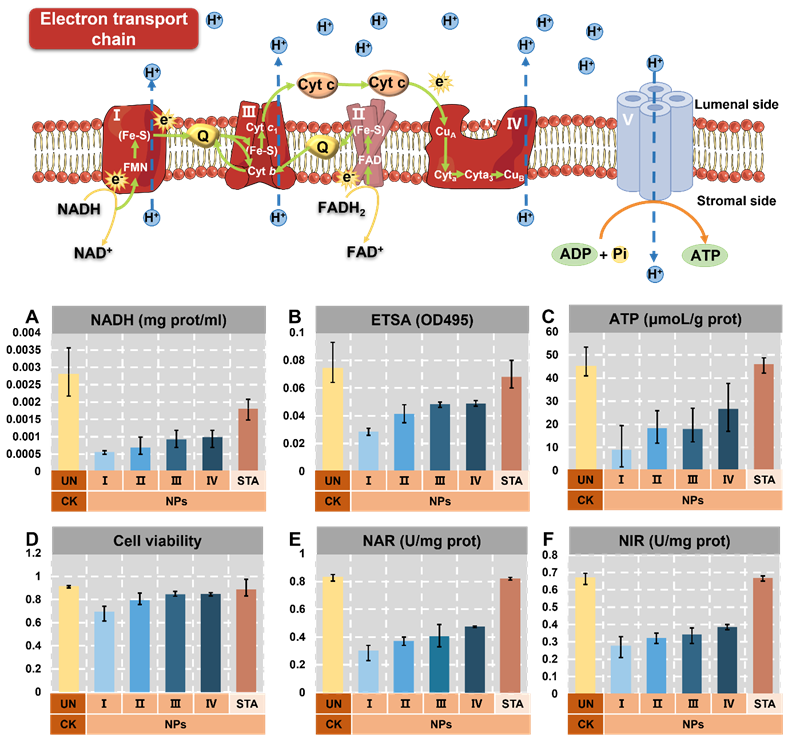
图3 NADH (A)、ETSA (B)、ATP (C)、细胞活力 (D)、NAR (E) 和 NIR (F) 水平对NPs 积累的响应
根据微生物共生网络分析结果显示,NPs暴露引发了微生物网络的不稳定性,微生物群落相应的采取了代偿性适应措施,如铁载体介导的铁摄取,以确保维持微生物的营养需求。研究还发现,在NPs暴露后,稳定期正相关比例为63.44%,与未处理组(60.89%)和早期(62.08%)相比略有增加,微生物之间的合作行为的增强有助于有效利用铁载体-铁复合物。然而,NPs暴露可能会损害微生物间的有效通讯,从而抑制氮代谢。另外,反硝化细菌在未处理组和稳定阶段可能发挥关键生态作用,而硝化细菌在早期阶段扮演重要角色。这强调了硝化过程的电子供应在NPs暴露下引发电子缺乏的重要性,也表明植物能够在外部环境压力下招募特定微生物分类群来满足其需求。
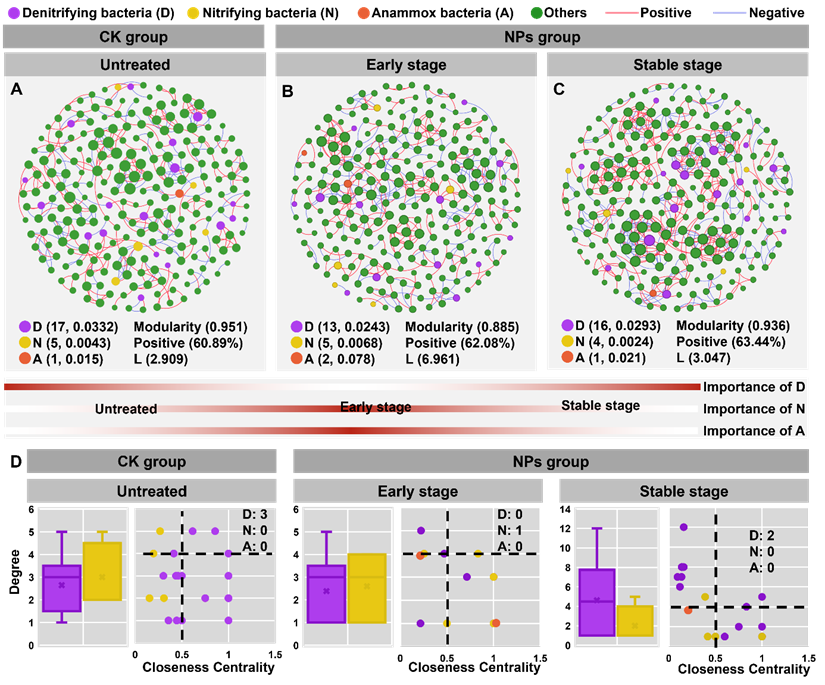
图4 未处理组(A)和NPs组(早期(B)和稳定期(C))的微生物共生网络。响应NPs暴露的拓扑特征(度和接近中心性)比较(D)
铁的氧化还原与氮转化之间紧密相关。针对NPs暴露引发的铁泄漏,本研究探究了细胞内铁含量对氮代谢的影响。结果表明,NPs暴露下,微生物采取复杂策略应对缺铁情况,铁载体通过特定受体和转运系统介导摄取,进入细胞的Fe3+需被进一步还原为Fe2+供微生物所利用。在氮代谢中,硝化、厌氧氨氧化、NADH和FADH的氧化过程被确认为Fe3+还原的主要贡献者。实验结果显示,NPs组中的hao相对丰度增加,可能导致氨氮和亚硝酸盐氧化受到抑制。在厌氧氨氧化过程中,NPs组早期和稳定期的相关基因表达增加,推动了Fe3+的还原。此外,NPs组早期阶段表现出编码复合物I和II的基因表达量增加,表明电子的产生和传递增强,可能导致NPs存在下Fe3+还原的增加。这些发现揭示了微生物在NPs暴露下对铁资源的复杂利用策略,以及铁氧化还原与氮转化之间的复杂相互作用。该研究也为未来关于微生物体内铁利用和氮转化的研究提供了基础,并促进NPs干扰下环境修复策略的发展。
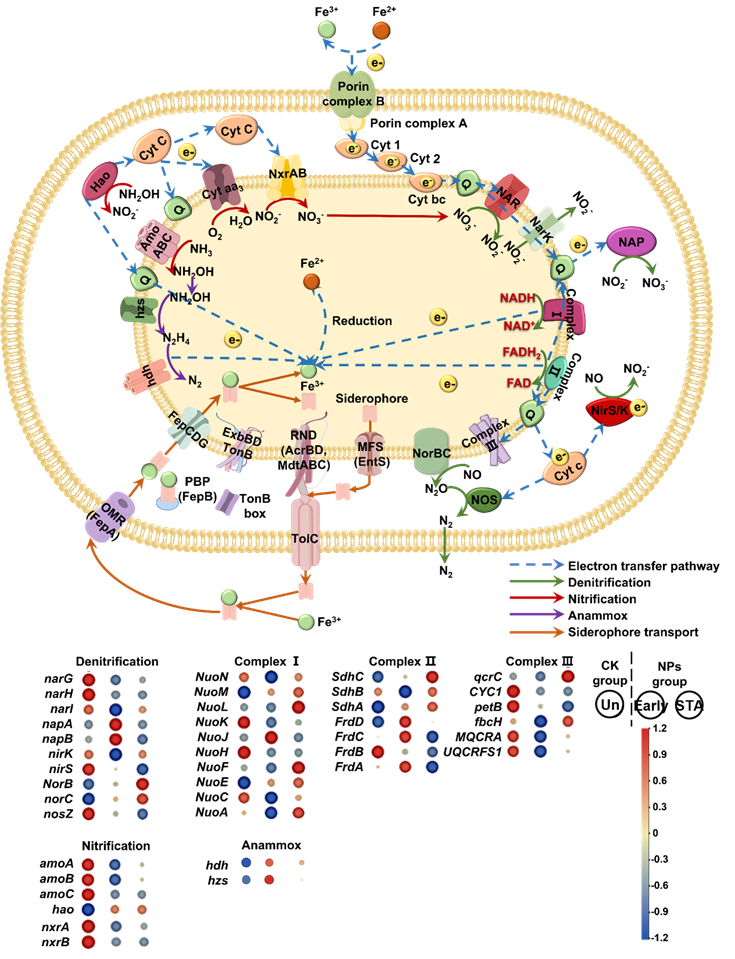
图5 NPs暴露下的铁-氮耦合机制
小结
NPs内化导致细胞内铁离子泄漏,触发微生物对缺铁的适应反应,促进铁载体的合成和摄取,进而维持微生物生长和代谢所需的铁离子。然而,Fe3+在细胞内可能与其他电子受体竞争,限制参与氮转化的电子转移过程。缺铁情况可能影响呼吸链电子传递活性和氮代谢关键酶的活性。在未处理组中,总氮去除效率分别比NPs组的早期和稳定期高1.43倍和1.01倍。这项研究为进一步阐明微生物体内铁利用和氮代谢之间的复杂相互作用提供新的见解。
‘’
